
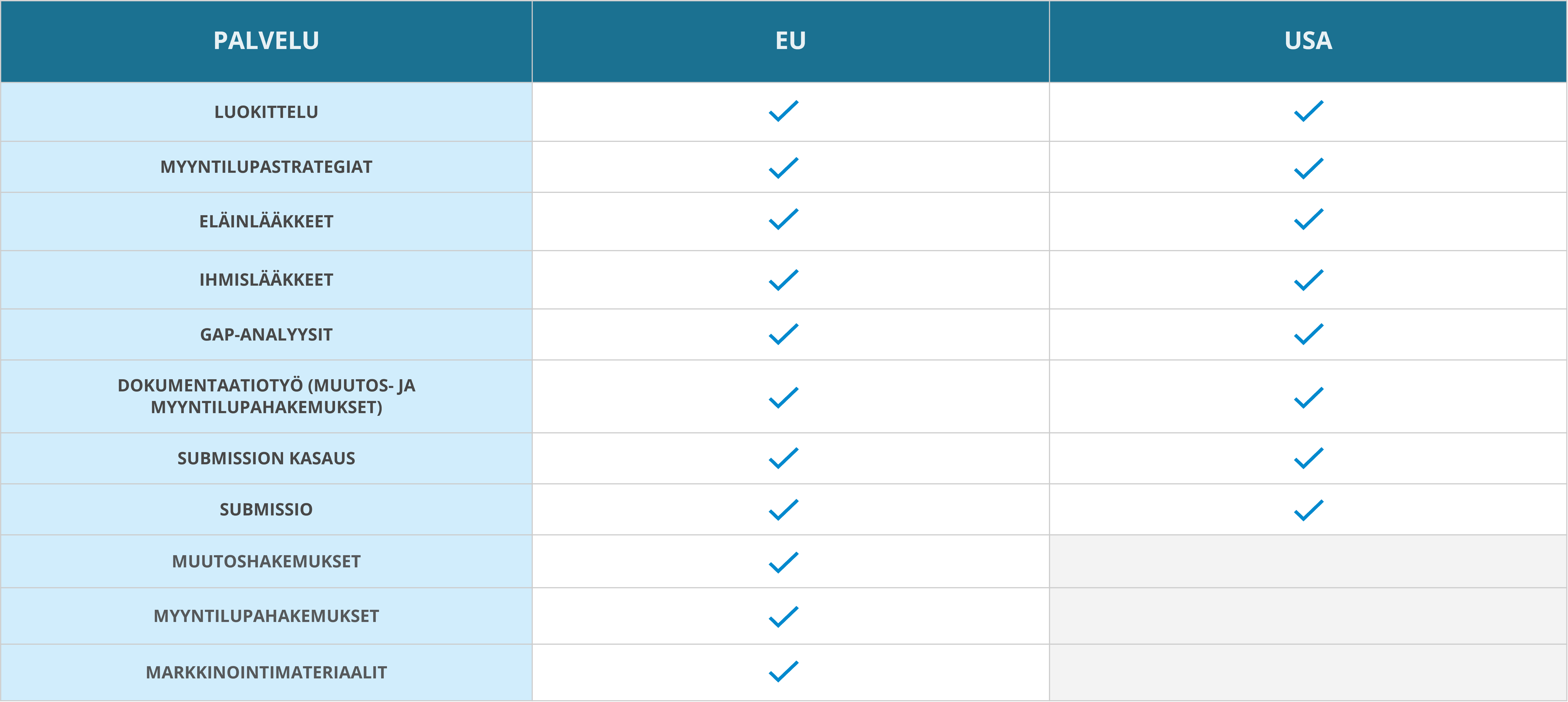
Ihmis- ja eläinlääkkeiden myyntilupapalvelut EU:ssa ja USA:ssa
Medfilesin asiantuntijat tarjoavat kattavia myyntilupapalveluja koko EU-alueelle sekä USA:han. Asiantuntijamme työskentelevät Suomessa, Virossa, Latviassa ja Liettuassa. Kvalifioitujen sopimuskumppaniemme kautta hallitsemme myös muiden yksittäisten EU-maiden kansalliset erityispiirteet ja pystymme hoitamaan myyntilupa-asioita minkä tahansa EU-viranomaisen kanssa. Voimme auttaa asiakkaitamme myyntilupiin liittyvissä tehtävissä myös USA:ssa.
Kansallisten tehtävien lisäksi toimimme mielellämme apunasi pääkonttoritason myyntilupa-asiantuntijana, ja voimme hallinnoida useita tai vaikka kaikkia EU-maita kattavia myyntilupien haku- ja ylläpitoprosesseja. Voimme olla tukenasi lääkkeiden elinkaaren kaikissa vaiheissa aina tuotekehityksestä myyntiluvan hakuvaiheeseen, rekisteröintiprosessiin ja myyntiluvan ylläpitoon tai auttaa tarvittavassa vaiheessa.
Valitsemalla asiantuntijamme avuksesi voit olla varma siitä, että lääkevalmisteesi vastaa viranomaisten vaatimuksia. Korkeasti koulutetuista ammattilaisista koostuvalla noin 40 hengen myyntilupatiimillämme on laaja työkokemus lääkealalta ja lupaviranomaisten palveluksesta. Palveluidemme korkean laadun takaamiseksi henkilöstömme kouluttautuu jatkuvasti ja on aina ajan tasalla viimeisimmistä vaatimuksista ja käytännöistä.
Maksuton opas: Mitä sinun tulee tietää lääkeaineen rekisteröinnistä?
Lääkeaineen laatu on osoitettava myyntilupahakemuksessa. Euroopassa tähän on kolme erilaista tapaa, joista sopivin valitaan vaikuttavan aineen perusteella. Olemme koonnut perusasiat lääkeaineen rekisteröinnistä oppaaseen, joka auttaa valitsemaan eri tilanteisiin parhaiten sopivan tavan.
Tutustu myyntilupapalveluihimme

Myyntilupapalvelut strategiasta myyntilupahakemukseen ja lanseeraukseen
Asiantuntijamme avustavat mielellään myyntilupahakemuksen strategisessa suunnittelussa jo aikaisessa tuotekehitysvaiheessa. Tuotekehityksen alkutaipaleella on tärkeä arvioida ja selvittää voidaanko uusi tuote luokitella lääkkeeksi vai ei. Lääkevalmisteen kohdalla myyntilupahakemuksen laillinen perusta määrittää, voiko lääkkeen tehon ja turvallisuuden osoittaa kirjallisuuden perusteella vai tarvitaanko tueksi nonkliinisiä tai kliinisiä tutkimuksia. Lisäksi on hyvä perehtyä hyvissä ajoin kohdemaissa mahdollisesti jo myyntiluvan saaneisiin vastaaviin lääkevalmisteisiin.
HUOLELLINEN PROJEKTISUUNNITTELU VARMISTAA SUJUVAN MYYNTILUPAPROSESSIN
Medfilesin omalla korkeasti koulutetulla asiantuntijatiimillä on keskimäärin yli 10 vuoden kokemus myyntilupatyöstä lääketeollisuudessa tai viranomaisen palveluksessa. Tietämyksemme viimeisimmistä vaatimuksista ja lainsäädännön muutoksista ovat aina ajan tasalla. Koulutamme asiantuntijoitamme säännöllisesti pysyäksemme mukana muutoksissa ja taataksemme asiakkaillemme viimeisimmän tiedon mukaisen asiantuntevan palvelun. Tarvittaessa hyödynnämme luotettavaa ja kvalifoitua yhteistyöverkostoamme taataksemme asiakkaillemme entistä laajemman palvelun.
Voimme huolehtia koko myyntilupahakemusprosessista mihin tahansa EU-maahan (DCP/MRP/CP/NP) aina rekisteröintistrategiasta myyntilupaan saakka. Jokaiseen asiakasprojektiin nimitetään oma projektipäällikkö ja oma projektitiimi. Tarvittaessa voit ulkoistaa meille myös vain osia prosessistasi. Viitoitamme tuotteesi tien tutkimusvaiheesta markkinoille tukemalla tuoteluokituksessa ja tieteellisessä neuvonnassa koko hakemusprosessin ajan.
EU:n osalta autamme mielellämme
- rekisteröintistrategian luomisessa
- tuoteluokituksissa; lääke, lääkinnällinen laite vai mahdollisesti ravintolisä
- myyntilupa-aineistojen GAP-analyyseissa
- myyntilupahakemusten laatimisessa ja käsittelyssä
- hakemusmenettelyjen koordinoinnissa
USA:n osalta autamme mielellämme
- markkinoiden laajentamisessa USA:han
- dokumentaatiotyössä (uudet myyntiluvat ja muutoshakemukset)
- rekisteröintistrategian luomisessa
- tuoteluokituksissa
Tarjoamme myös kattavaa koulutusta uusista myyntilupahakemuksista ja myyntilupastrategioista.
Olemme avustaneet asiakkaitamme yli 100 myyntilupaprosessissa. Kokemuksemme eri myyntilupamenettelytyypeistä:
- 55 % DCP (hajautettu menettely)
- 24 % MRP (tunnistamismenettely)
- 17 % NP (kansallinen menettely
- 4 % CP (keskitetty menettely)
Autamme myös markkinoille pääsyyn (market access) liittyvissä tehtävissä:
- hinta- ja korvattavuushakemuksissa
- myyntilupien uudistamishakemuksissa
- hintavertailuissa ja hintatason määrittelyissä
- viitehintailmoituksissa
Katso myös:

Myyntilupien ylläpitopalvelu varmistaa myyntiluvan ajantasaisuuden
Myyntilupien asiantuntevalla ylläpidolla varmistetaan lääkevalmisteen myyntiluvanmukaisuus sekä markkinoilla pysyminen ja saatavuus. Kokenut myyntilupatiimimme tarjoaa kattavia myyntilupapalveluja ihmis- ja eläinlääkkeille vaikuttavasta aineesta riippumatta. Voit ulkoistaa meille joko tuotteesi koko ylläpidon tai tiettyjä osia siitä. Monipuolisen taustan omaava ja korkeasti koulutettu tiimimme on erikoistunut myyntilupien ylläpitoon Euroopassa ja voi konsultoida sekä auttaa myös markkinoiden/myyntilupien laajentamisessa USA:han.
Tiimiltämme löytyy myös erityisosaamista Pohjoismaiden ja Baltian maiden paikallisista vaatimuksista. Asiantuntijamme voivat työskennellä joko Medfilesin toimistolta käsin tai asiakkaan toivomuksesta myös asiakkaan omissa tiloissa.
Voit ulkoistaa meille
EU:n osalta
- viranomaisten vaatimat myyntilupien muutoshakemukset, ilmoitukset ja uudistamishakemukset
- muutokset reseptivalmisteesta itsehoitolääkkeeksi; Rx / OTC
- myyntilupien siirrot uudelle myyntiluvanhaltijalle
- markkinointimateriaalien tarkistukset
- myyntilupien ylläpitoa koskevat koulutukset.
USA:n osalta
- tuki markkinoiden laajentamiseen USA:han
- dokumentaatiotyö (muutoshakemukset)
Yllä mainittujen palvelujen lisäksi asiantuntijamme voivat toimia teillä osa- tai kokoaikaisena ulkoistettuna resurssina haastavissa tilanteissa. Ulkoistamispalvelun avulla voitte paikata henkilöstövajettanne tai saada sijaisen tuuraamaan esimerkiksi vakituisen työntekijän pidemmän vapaan tai sairasloman ajaksi.
Eläinlääkkeiden myyntilupapalvelut EU:ssa, UK:ssa ja USA:ssa
Medfiles tarjoaa myyntilupapalveluita myös eläinlääkkeille. Eläinlääke-tiimiimme kuuluu useita eläinlääkkeiden lainsäädäntöön ja viranomaisohjeistuksiin perehtyneitä kokeneita asiantuntijoita. Tiimimme hallitsee EU:n eläinlääkeasetuksen, UK:n kansallisen lainsäädännön ja VMD-viranomaisohjeistuksen sekä USA:n FDA-ohjeistukset.
Meillä on yli 10 vuoden kokemus eläinlääkkeiden rekisteröinneistä. Pidämme yllä ajantasaista osaamistamme. Seuraamme jatkuvasti alan ohjeistuksia ja osallistumme EMA:n, FDA:n, MPA:n, Fimean ja VMD:n järjestämiin viranomaiskoulutuksiin sekä muihin alan ajankohtaisiin koulutuksiin. Koulutamme myös asiakkaitamme eläinlääkkeiden lainsäädäntöön ja rekisteröintiin liittyen – kysy juuri sinun tiimillesi tai yrityksellesi räätälöityä koulutusta.
Osaava ja omistautunut eläinlääke-tiimimme auttaa sinua esimerkiksi seuraavissa:
EU:n ja UK:n osalta
- luokittelu eläinlääkkeeksi (eläinlääke vs. lääkinnällinen laite, eläinlääke vs. rehu/ravintolisä)
- myyntilupastrategiat
- uudet myyntiluvat (NP, DCP, SRP, CP)
- uudet vet ASMF -submissiot
- VNeeSin kasaaminen ja submissio EU- ja UK-alueelle (VMDS, EMA gateway ja CESP)
- eläinlääkekohtainen dokumentaatio, kuten Part 1, Part 1c1, Part 2/module 3
- eläinlääkkeiden tuotetekstien laadinta, päivitys ja käännökset (mm. v 9.0)
- eläinlääkkeiden pakkausmateriaalien oikoluvut ja kansalliset vaatimukset
- lanseerausvaiheen rekisteröintiasiat kansalliset vaatimukset, pakkausmateriaalit, kansallisten tietokantojen päivitys, markkinointimateriaalin tarkistus)
- myyntilupien ylläpito (VRA, VNRA, UPD, implementoinnit)
- rinnakkaisten prosessien/variaatioiden hallinnointi yhtäaikaisesti eri viranomaisten kanssa (parallell)
USA:n osalta
- luokittelu eläinlääkkeeksi ja myyntilupastrategiat
- myyntilupa-aineistojen GAP-analyyseissa (EU vs USA)
- dokumentaatio uutta myyntilupaa varten (ANADA, NADA) ja muutosilmoitusta varten, mukaan lukien tuotetekstien laadinta
Yllä mainittujen palvelujen lisäksi myyntilupa-asiantuntijamme voivat toimia teillä osa- tai kokoaikaisena ulkoistettuna resurssina. Tiimimme on aina apunasi – voit ulkoistaa meille koko projektin tai osia siitä.
Eläinlääke-tiimimme toimii yhteistyössä Medfilesin muiden yksiköiden kanssa. Voit ulkoistaa meille esimerkiksi eläinlääkkeiden lääketurvaan liittyvät tehtävät. Lisäksi rehutiimimme tarjoaa palveluita rehu- ja rehulisäaineille aina tuotekehityksestä lainsäädäntöselvityksiin, rekisteröintiin ja markkinointiin.
Katso myös:

Farmaseuttis-kemialliset (CMC) asiantuntijapalvelut ja CMC-konsultointi
Farmaseuttis-kemiallisten (CMC) vaatimusten ymmärtäminen edesauttaa lääkevalmisteen mahdollisimman nopeaa pääsyä potilaiden käyttöön. Medfiles tarjoaa monipuolisia CMC-konsultointiin ja -dokumentaatioon liittyviä asiantuntijapalveluita – kokenut asiantuntijatiimimme huomioi voimassa olevat vaatimukset, kirjoittaa myyntilupadokumentaation vuosien kokemuksella ja auttaa välttämään tarpeettomat viivästykset tuotekehityksen ja rekisteröinnin aikana.
Ammattitaitoinen tiimimme kouluttautuu jatkuvasti pysyäkseen ajan tasalla uusimmista ohjeistoista. Laaja työkokemuksemme lupaviranomaisen palveluksesta ja lääketeollisuudesta takaa tehokkaat ja laadukkaat palvelut. Takaamme osaaville asiantuntijoillemme tarvittaessa varahenkilöt projektin kestosta riippumatta. Hoidamme dokumentaatiotyöt puolestasi esimerkiksi EU:n lääkeviranomaisille tai FDA:lle toimitettaviin usiin myyntilupiin ja yksittäisiin muutoshakemuksiin. CMC-konsultoinnin ja CMC-dokumentaation räätälöimme kunkin asiakkaan tarpeiden mukaan osaksi isompia palvelupaketteja yhdessä Medfilesin rekisteröintipalveluiden, tuotekehitys- ja analytiikkapalveluiden, kliinisten tutkimuspalveluiden ja lääkinnällisten laitteiden palveluiden kanssa.
Farmaseuttis-kemiallinen dokumentaatiopalvelumme kattaa seuraavat osa-alueet:
- Myyntilupahakemukset
- moduuli 3:n tai Part II:n dokumentaatio
- laatuyhteenvedot
- lisäselvityspyynnöt
- hakemusaineiston arviointi (gap-analyysi)
- Muutoshakemukset
- muutoshakemuksiin liittyvä konsultointi ja luokittelu
- dokumentaation laatiminen
- Kliinisen lääketutkimuksen hakemusdokumentaatio (IMPD, IND)
- Vaikuttavan aineen dokumentaatio (ASMF, DMF ja CEP)
- Validointisuunnitelmat ja -raportit
- Riskinarviot (nitrosamiinit, elemental impurities)
- Konsultointi ja koulutukset
PROJEKTINHALLINTA, LÄÄKEKEHITYS JA TEKNOLOGIAN SIIRROT
CMC-tiimin asiantuntijoillamme on pitkä työkokemus sekä analyyttisesta kemiasta että valmistusprosesseista. Olemme avustaneet asiakkaitamme useissa erilaisissa kehitysprojekteissa ja teknologian siirroissa. CMC -asiantuntijamme ovat kokeneita analyysimenetelmien siirtojen koordinoinnissa ja analytiikan konsultoinnissa.
Saat kauttamme seuraavat palvelut:
- Ulkoistetut asiantuntijat projekteillesi niin valmistusprosesseihin kuin analytiikkaan
- Teknologian siirtojen osaava koordinointi viranomaisvaatimukset huomioiden
- Laatudokumentaation kokoaminen tukemaan sujuvaa teknologian siirron viranomaishyväksyntää
“Medfilesin asiantuntijan apu oli korvaamaton analyyttistä ongelmaa selvitettäessä. Kiitos työpanoksesta, joka ylitti odotuksemme!”
– Asiakaspalaute v. 2023
Katso myös:

Sähköinen myyntilupa-asiointi (eSubmission)
Erityisesti pienille yrityksille eCTD-julkaisutyökalujen vuosittaiset kulut voivat olla työkalun todelliseen tarpeeseen nähden merkittävät. Tällaisissa tapauksissa on kannattavaa säästää resursseja ja ulkoistaa eCTD-julkaisutehtävät Medfilesille. Meillä on yli 10 vuoden kokemus eCTD-julkaisemisesta, joten saat meistä osaavan ja luotettavan kumppanin kaikkiin eCTD-julkaisuun liittyviin tehtäviin.
Me Medfilesilla käytämme eCTD-julkaisutyökalua, joka on laajalti eri viranomaisten käytössä ympäri maailmaa. Kokoamme sähköiset hakemukset voimassa olevien säädösten ja ohjeistojen mukaisesti. Käytämme eCTD:ssä ja VNeeS:ssä asianmukaisen validointityökalun kulloinkin voimassa olevaa versiota varmistaaksemme, että koottu sekvenssi on teknisesti kunnossa, ja lähetämme hakemuksen viranomaisille ilmoitettuja väyliä (esim. CESP tai EMA Gateway) pitkin.
Sähköiseen myyntilupa-asiointiin liittyvien palveluidemme korkean laadun takaa tiimimme laaja kokemus kaikista sähköisistä hakemusformaateista sekä mahdollisuus tukeutua tarvittaessa muihin lääketieteen tai farmasian asiantuntijoihimme. Sähköistä myyntilupa-asiointia koskevat hintamme sisältävät aina toisen asiantuntijan tekemän tuplatarkastuksen.
Meidän kauttamme onnistuu:
- eCTD:n, VNeeS:n ja muuntyyppisten sähköisten hakemusten sekvenssien kokoaminen
- hakemusten jätöt CESP-portaalin, EMA Gatewayn, Eudralinkin, FDA ESG:n tai turvasähköpostin kautta
Katso myös:

Lääkkeiden tuoteinformaatio- ja käännöspalvelut
Tuoteinformaatiotiimiimme kuuluu useita kääntäjiä ja myyntilupa-asiantuntijoita, joilla on vuosien kokemus valmisteyhteenvetoihin, pakkausselosteisiin ja myyntipäällysmerkintöihin liittyvistä tekstitöistä. Asiantunteva tiimimme toimittaa helppolukuiset, vaatimustenmukaiset ja kohderyhmän mukaan räätälöidyt tekstit tiukassakin aikataulussa. Käännöstöissä hyödynnämme myös käännösmuistiohjelmaa termistön ja ilmaisujen yhtenäisyyden varmistamiseksi. Käännösprosessiimme kuuluu regulatorinen tarkistus: parhaan mahdollisen laadun varmistamiseksi jokainen teksti kulkee kahden silmäparin kautta.
Saat meiltä seuraavat palvelut:
- tuoteinformaatiotekstien laatiminen
- tuoteinformaatiotekstien käännökset
- suomeksi, ruotsiksi, englanniksi, viroksi, latviaksi ja liettuaksi
- muille kielille tarvittaessa sopimuskumppaniemme kautta
- pakkausselosteiden käyttäjätestit ja bridging-raportit
- myyntipäällysmerkintöjen vedosten (mock-up) oikoluku
- valmisteyhteenvetolyhennelmien laatiminen ja päivittäminen
- paikallisten viranomaistietokantojen päivittäminen

Lääkkeiden markkinointimateriaalien tarkistus paikalliset vaatimukset huomioiden
Tarjoamme markkinointimateriaalien tarkistuspalveluja maakohtaisten määräysten ja lääkkeiden tuoteluokittelun (Rx/OTC) mukaisen markkinoinnin sääntelyn noudattamiseksi. Palvelumme sisältää lääketieteellisen, kielellisen ja eettisen tarkistuksen. Voit olla varma, että tarkistusprosessimme jälkeen materiaalisi lääketieteelliset faktat, kieli, väitteet ja viitteet noudattavat paikallista lainsäädäntöä ja eettistä ohjeistoa, markkinoinnillisesta otteesta tinkimättä.
Asiantuntijoillamme on mittava kokemus erilaisista markkinointimateriaaleista ja työskentelystä niin pienten kuin suurten monikansallisten lääkeyritysten kanssa. Meiltä löytyy paikallista asiantuntemusta Pohjoismaista sekä Baltian maista. Kokenut markkinointimateriaalien tarkistustiimimme tarkistaa materiaalit paikallisten vaatimusten mukaisesti, ja annamme selkeää ja rakentavaa palautetta kustakin markkinointimateriaalista. Otamme kantaa myös materiaaleihin liittyviin mahdollisiin riskeihin ja tarjoamme ratkaisuja niiden voittamiseksi.
Tarkistamme teille mielellämme:
- Itsehoitolääkkeiden tuote-esitteet, some-materiaalit, verkkosivut, mainosvideot
- Reseptilääkkeiden tuote-esitteet ja muut materiaalit
- Yrityksen PowerPoint-esitykset ja muut esitysmateriaalit
- Yrityksen kutsukirjeet
Järjestämme mielellämme myös räätälöityjä koulutuksia aiheesta.

Hyvät jakelutavat (GDP), vastuunalainen johtaja ja tuotevalitusten käsittely
Medfiles tarjoaa lääketukkukaupan vastuunalaisen johtajan palveluja Suomessa. Kaikilla kelpoisuusehdot täyttävillä lääketukkukaupan vastuunalaisten johtajien tiimimme asiantuntijoilla on farmasian alan tutkinto, osaamista, kokemusta ja koulutusta hyvistä jakelutavoista (GDP) sekä syvällinen lääkealan tuntemus. Meiltä saat vastuunalaisen johtajan palvelut tarpeidesi mukaan; kokoaikaisen vastuunalaisen johtajan tai vaikkapa tilapäisen varahenkilön esimerkiksi loman ajaksi. Tiimillämme on laaja tietämys myös tuotevalitusten käsittelystä, ja meiltä löytyy apua myös muihin GDP:hen liittyviin tehtäviin.
Voitte räätälöidä yrityksenne tarpeiden mukaisen paketin seuraavista:
Vastuunalaiset johtajat suomessa
- Kokoaikainen oma nimetty työntekijä
- Varahenkilö
- Delegoidut tehtävät
GDP-palvelut
- Tukkukaupan toimilupahakemukset
- Vakioitujen toimintaohjeiden (SOP) laatiminen ja päivitys
- GDP-auditoinnit
- GDP-koulutukset ja konsultointi
- Konsultointipalvelut
- maahantuonti ja logistiikka
- huumausainevalvonta ja velvoitevarastointi
- Tuotevalitusten käsittely
Räätälöimme palvelumme aina asiakkaamme tavoitteiden ja tarpeiden mukaisesti. Ole rohkeasti yhteydessä ja kysy tarjousta myyntilupapalveluistamme.
Miksi ulkoistaa myyntilupatehtäviä Medfilesille?
Myyntilupatiimillämme on pitkä ja laaja kokemus ihmis- ja eläinlääkkeistä, steriileistä ja ei-steriileistä valmisteista sekä biologisista lääkkeistä. Asiantunteva 40 hengen tiimimme koostuu farmaseuttisen, luonnontieteellisen ja kemiantekniikan koulutuksen omaavista asiantuntijoista.
Voit ulkoistaa meille erilaiset tuotteen elinkaareen liittyvät regulatoriset tehtävät riippumatta siitä, onko yrityksesi pieni, keskikokoinen tai iso tai akateeminen tutkimusorganisaatio.
Pystymme avustamaan esim.
- EU:n ulkopuolisia yrityksiä, joilla ei ole riittävästi kokemusta ja asiantuntemusta EU:n lääkelainsäädännöstä.
- yrityksiä, joilla ei aikaisemmin ole ollut lääkkeiksi luokiteltuja valmisteita tuotevalikoimassaan.
- yrityksiä, jotka haluavat ulkoistaa rutiinitehtäviä ja priorisoida aikansa johonkin muuhun, esimerkiksi uusiin tuotekehityshankkeisiin.
- yrityksiä, jotka kohtaavat yllättäviä tai haasteellisia resurssimuutoksia. Meiltä voit kysyä asiantuntijaa yritykseesi koko- tai osa-aikaisesti lyhyeen tai pidempiaikaiseen ulkoistukseen.
- yrityksiä, joilla on tuotteita monessa eri tuotekategoriassa: lääkkeet, lääkkeet lääkinnälliset laitteet, IVD-laitteet, ravintolisät ja kosmetiikka. Meiltä löytyy asiantuntevat tiimit jokaiselle eri tuotekategorialle. Rajapintatuotteissa toimimme tiiviissä yhteistyössä tiimien kesken ja voimme avustaa esim. rekisteröintireitin valinnassa.
- yrityksiä, joilla on projekteja, joissa tarvitaan laaja-alaista osaamista; meiltä löytyy saman katon alta kliiniset tutkimuspalvelut, tuotekehitys- ja laboratoriopalvelut, myyntilupa- ja lääketurvapalvelut sekä käännöspalvelut.
Yli 30 vuoden kokemus myyntilupa-asioista
100+
myyntilupaprosessia
1600+
Variaatiota / uudistamishakemusta
1500+
Viranomaissubmissiota / vuosi
200+
Markkinointimateriaalin tarkistusta / vuosi
Ota yhteyttä
Sinua voisi kiinnostaa:
- Maksuton opas: Mitä sinun tulee tietää lääkeaineen rekisteröinnistä?
- Lääkkeen myyntilupa tehokkaasti kaikkiin EU-maihin
- Maksuton opas: Lääkkeiden säilytysolosuhteiden määrittäminen
- Parhaat käytännöt analyysimenetelmien siirtoon
- Keskitetty myyntilupaprosessi vaatii monipuolista asiantuntijuutta – Medfilesin ammattitaito moottorina eläinlääkkeen myyntiluvassa
- Parhaat käytännöt eläinlääkkeiden QRD-templaattipäivityksiin
- 12 asiantuntijan tiimi tarjoaa laadukkaat myyntilupapalvelut Baltian maissa
Medfiles kuuluu yli 90 maata kattavaan regulanet® -verkostoon.

