
Kliiniset tutkimuspalvelut lääkinnällisille laitteille, elintarvikkeille ja lääkkeille
Medfiles tarjoaa lääkinnällisten laitteiden, IVD-laitteiden, lääkevalmisteiden ja elintarvikkeiden tutkimukseen liittyviä kokonaisvaltaisia kliinisiä tutkimuspalveluja. Tuemme kliinisten tutkimusten toimeksiantajia kaikissa tutkimuksen vaiheissa aina varhaisen vaiheen pilottitutkimuksista markkinoille saattamisen jälkeisiin tutkimuksiin. Tarjoamme saman katon alta räätälöityjä ratkaisuja sekä kattavia palvelupaketteja tutkimuksen suunnittelusta loppuraportointiin. Palveluvalikoimaamme kuuluvat muun muassa projektien koordinointi, lääketieteellinen kirjoittaminen, hakemusten toimittaminen viranomaisille, tutkimuksen valmistelutoimet, vaaditut tutkimusdokumentit, monitorointi, tiedonhallinta, tilastollinen käsittely ja tutkimuksen loppuraportointi.
Tiimimme kokeneet tutkimuskoordinaattorit ja projektipäälliköt varmistavat koko tutkimuksen ajan, että projektisi saadaan päätökseen annetun aikataulun ja budjetin puitteissa ja kansainvälisten laatustandardien vaatimusten mukaisesti. Laajan partneriverkostomme avulla tarjoamme palveluja kliinisiin tutkimuksiin Pohjoismaiden ja Baltian maiden lisäksi myös muissa Euroopan maissa. Ota yhteyttä!
Vahva kliinisten tutkimusten osaaminen ja kokemus
Koulutamme työntekijöitämme jatkuvasti ja seuraamme tarkasti ohjeiden, määräysten ja lainsäädännön muutoksia, jotta voimme varmistaa asiakkaillemme laadukkaat ja aina viimeisimpien vaatimusten mukaiset palvelut. Lääkinnälllisten laitteiden kliiniset tutkimukset ja ruokavaliointerventiot ovat erityisosaamistamme.
30+
vuotta kokemusta
1000+
Tutkimuskeskusta
320+
kliinistä tutkimusta
150 000+
Tutkittavaa
Meillä on runsaasti kokemusta useilta terapia-alueilta:
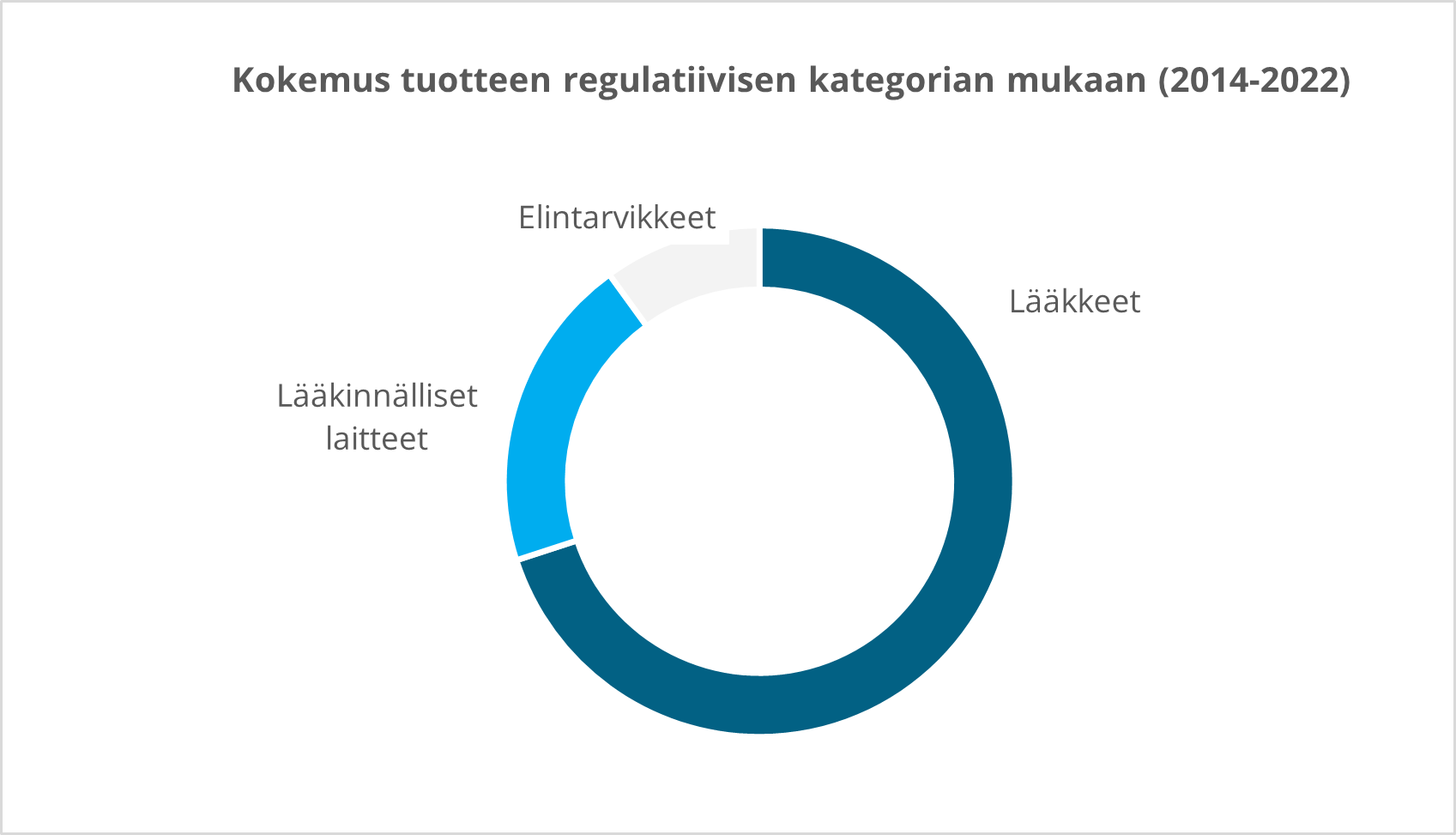
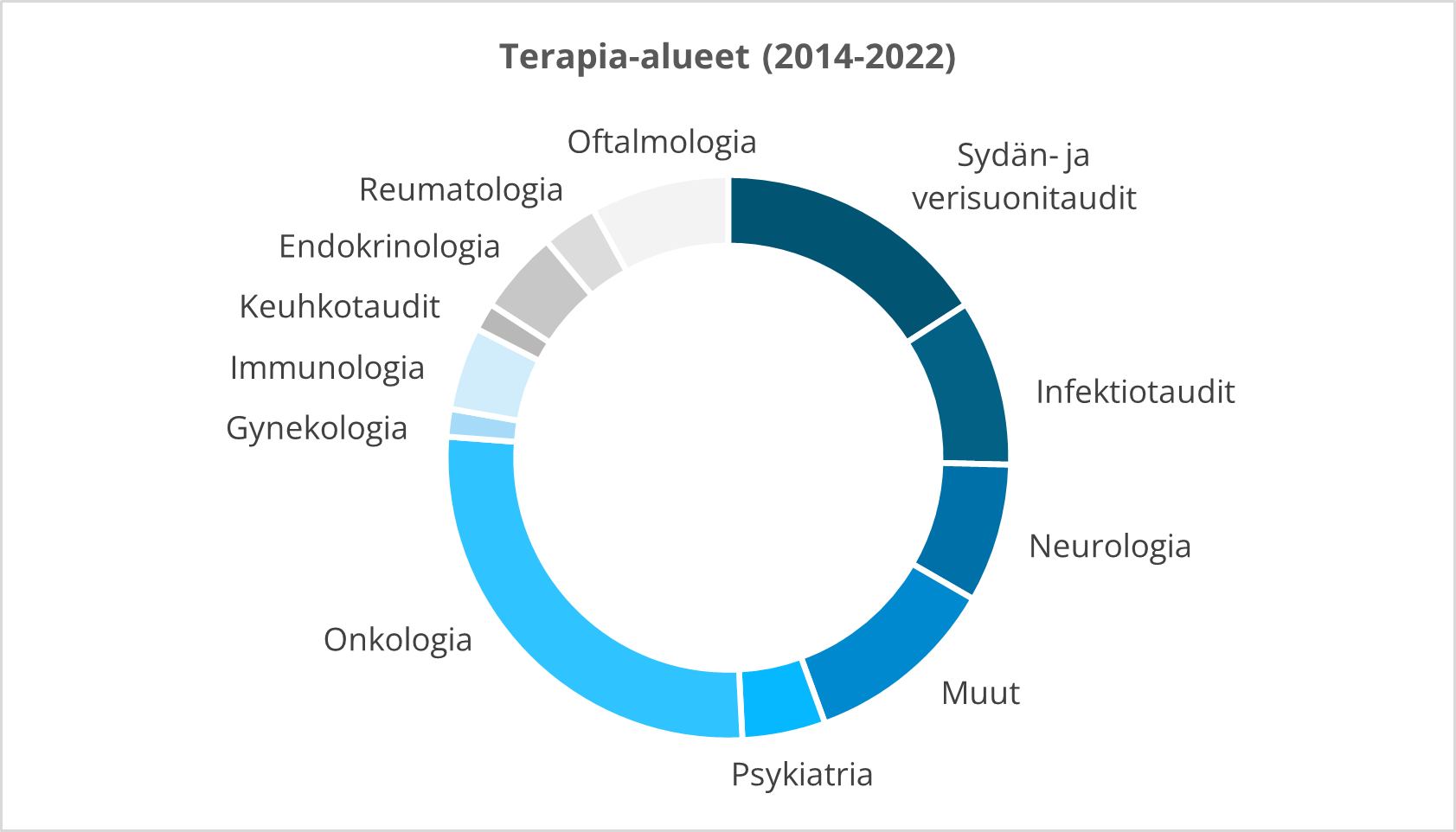
Kliiniset tutkimuspalvelut

Kliinisten tutkimusten projektinhallinta
Jokaisen tutkimukseen nimetään projektiin parhaiten sopiva oma projektipäällikkö, jolla on kokemusta ja osaamista kliinisestä tutkimustyöstä. Projektipäällikkö tarjoaa apua ja huolehtii koordinoinnista koko kliinisen tutkimuksen ajan sekä viestii kaikista tutkimusta koskevista asioista asiakkaan toivomalla tavalla. Projektipäällikkö toimii yhteyshenkilönä kaikkien tutkimuksen osapuolten välillä sekä toimeksiantajan ja Medfilesin välillä.
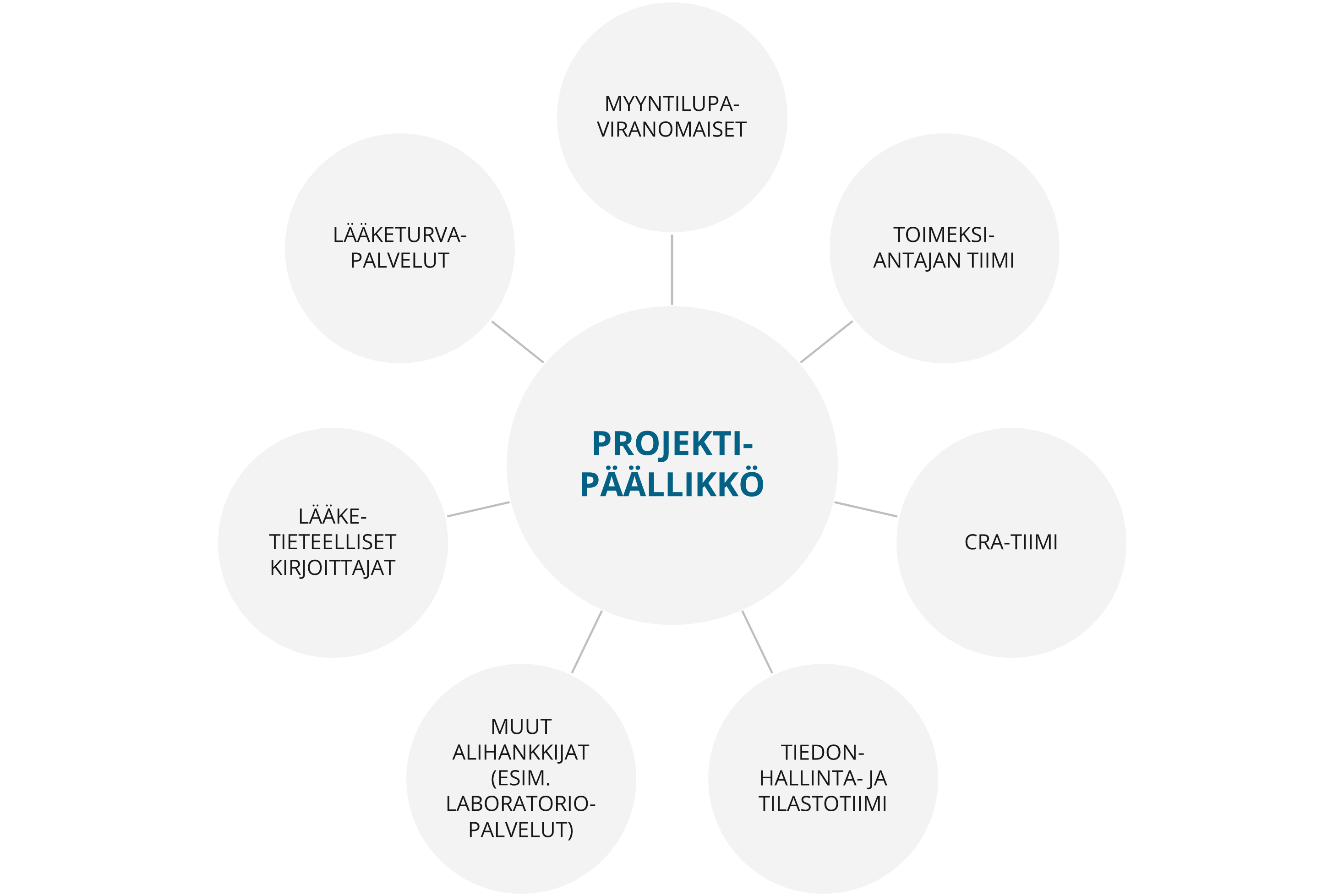
Projektipäälliköidemme tehtäviin kuuluvat mm. seuraavat:
- tutkimuksen edistymisen varmistaminen
- toimiminen ensisijaisena resurssina ja yhteyshenkilönä toimeksiantajan ja projektitiimin välillä
- alihankkijoidemme ja teknisten resurssien (mukaan lukien eCRF:n, eTMF:n ja sähköisen potilaskertomuksen palveluntarjoajat) tehokas hyödyntäminen
- tutkimuskeskusten valinnan ja toteutettavuusanalyysin optimointi
- projektitiimin johtaminen ja ohjaaminen, mukaan lukien aikataulujen, laadun sekä projektikustannusten seuranta
- riskien tunnistaminen, dokumentointi ja vähentäminen jo prosessin varhaisvaiheessa tutkimuksen mahdollisten esteiden ehkäisemiseksi
- projektitiimin tuloksen proaktiivinen seuranta ja kehittäminen
- ongelmista ja ratkaisuista tiedottaminen
- ”entä jos” -skenaarioiden arvioiminen
- kokonaiskuvan muodostaminen tutkimuksesta, tutkimussuunnitelmasta ja toimeksiantajan päämääristä
- hakemusten ja tarvittavien asiakirjojen toimittaminen riippumattomille eettisille toimakunnille ja viranomaisille.

Kliinisten tutkimusten valmistelu ja aloitus
Medfilesilta saat aina henkilökohtaista ja nopeaa palvelua: käytettävissäsi ovat nimetyt asiantuntijamme, joiden kanssa on helppoa ja vaivatonta hoitaa kaikki tutkimuksen valmisteluun ja aloitukseen liittyvät asiat. Lääketieteelliset kirjoittajamme voivat tulla mukaan projektiin jo suunnitteluvaiheessa. Tutkimuskeskusten ja tutkijoiden sitouttaminen ja kvalifiointi ovat ratkaisevan tärkeitä kliinisissä tutkimuksissa. Laaja tutkimusverkostomme Pohjoismaissa ja Baltian maissa takaa, että tutkimuskeskukset suoriutuvat työstään laadukkaasti.
Tutkimusten valmistelu etenee seuraavasti:
Kliinisen tutkimuksen suunnittelu
- Konsultointi tutkimusasetelman valinnassa
- Tutkimussuunnitelmien kirjoittaminen
- Tutkimussuunnitelmien arviointi viranomaisen ja GCP:n näkökulmasta
- Tutkimuksen aikataulun suunnittelu
- Viranomaisvaatimuksia (paikalliset vaatimukset ja EMAn ja EFSAn vaatimukset) ja GCP-vaatimuksia (EMAn ja EFSAn vaatimukset) koskeva konsultointi
Tutkimuskeskusten löytäminen ja kvalifiointi
- Kliinisten tutkimusten tutkimussuunnitelmat ja niiden toteuttavuusarviointi
- Päätutkijan (PI) ja tutkimuskeskusten identifiointi
- Tutkimuskeskusten kvalifiointi
- Tutkimuskeskusten valinta toimeksiantajan kanssa
- Toteutettavuus- ja kvalifiointidokumentaatio
Tutkimuksen aloitus
- Projektin käynnistys ja tutkijoiden kokoukset
- Ilmoitukset tutkimusrekistereihin, kuten EU-portaaleihin (CTIS ja EFSA) sekä ClinicalTrial.gov-rekisteriin
- CTIS portaalin käyttötuki
- Käännökset ja tekstien lokalisointi esimerkiksi suostumusasiakirjoista, tutkimustiivistelmistä ja potilaspäiväkirjoista
- Hakemusten toimittaminen
- Hakemukset riippumattomalle eettisille toimikunnille ja viranomaisille muihin kuin lääketutkimuksiin ja non-interventiotutkimuksiin liittyen
- Lääketutkimuksissa Osien I ja II hakemusten toimittaminen CTIS-portaaliin
- Tutkimuksen dokumentaatio, kuten projektisuunnitelmat, (e)TMF suunnitelma ja TMF:n perustaminen, , monitorointisuunnitelma ja tutkijan kansion (ISF) perustaminen
- Suunnitelma haittatapahtumien käsittelyyn – ja muun valvontatoiminnan valmistelu
- Tietojen hallinta (eCRF:ien suunnittelu, valmistelu ja arviointi) ja tilastollisen analyysin suunnitelma
- Sopimukset ja neuvottelut tutkimuskeskusten ja muiden alihankkijoiden kanssa
- Tutkimuksen aloituskäynnit tutkimuskeskuksissa
- Tutkimuskeskusten henkilöstön koulutus ja tuki

Kliinisten tutkimusten monitorointi
Medfiles kokoaa sopivan tiimin kunkin uuden tutkimuslääkkeen, elintarvikkeen tai lääkinnällisen laitteen kliiniseen tutkimusohjelmaan ja varmistaa näin laadukkaan tietojen arvioinnin ja tuen tutkimuskeskuksille. Meillä on vahva edustus Suomessa, Ruotsissa, Virossa, Latviassa ja Liettuassa sekä koko Euroopan kattava alueellisten kliinisten tutkimuskoordinaattoreiden verkosto. Kokeneilla projektipäälliköillämme ja tutkimuskoordinaattoreillamme on monipuolinen koulutus ja erityistietämystä kliinisten lääketutkimusten monitoroinnista ja viranomaisten ohjeistuksista monilla eri terapia-alueilla.
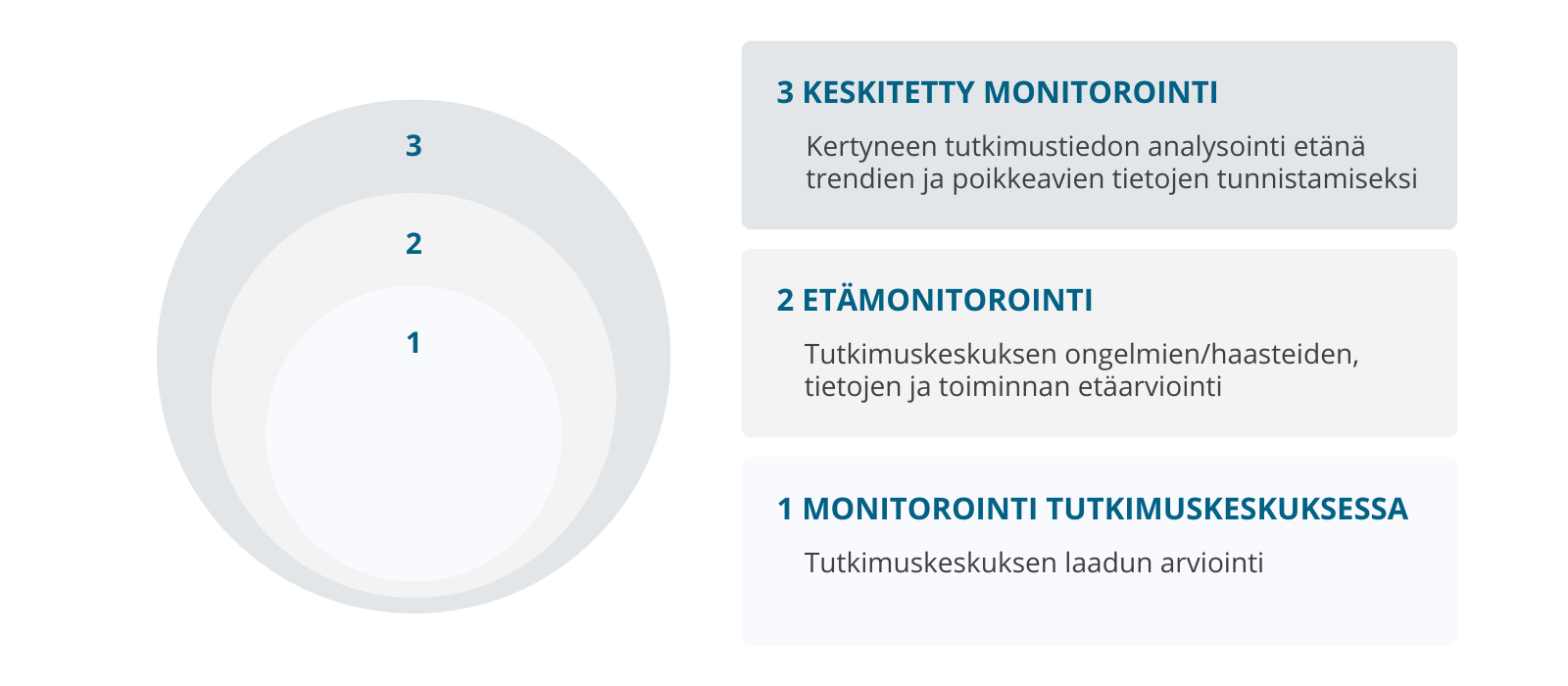
Avustamme seuraavissa asioissa:
GCP-vaatimusten noudattamisen varmistaminen
Monitorointistrategia ja -suunnitelma
- tutkimuskeskuksessa vai etänä
- keskitetysti
- yhdenmukaiset käytännöt
- kertyneen tiedon etäarviointi
- riskiperusteinen monitorointi
- riskin arviointiin perustuva monitorointi
- dynaaminen prosessi
- signaalien havaitseminen
- tieteellinen arviointi
Tutkimusdokumentit
- välttämättömien dokumenttien kokoaminen
- kliinisen lääketutkimuksen kantatiedoston (TMF) ylläpito
- Agatha eTMF elektroninen TMF:n ylläpito
- tutkimuksen välttämättömien dokumenttien (ISF) ylläpito
- tutkimukseen liittyvien suunnitelmien ja ohjeiden päivittäminen
Riippumattoman eettisen toimikunnan ja viranomaisen päivitykset
- hakemusten ja ilmoitusten toimittaminen merkittävistä muutoksista ja muista muutoksista
- tutkimuksen tilannepäivitykset esimerkiksi CTIS-portaaliin
- yhteydenpito riippumattoman eettisen toimikunnan ja toimivaltaisten viranomaisten kanssa
Turvallisuus ja valvonta
- haittatapahtumien ja vakavien haittatapahtumien kerääminen ja käsittely
- kliinisten lääketutkimusten vuosittaiset turvallisuusraportit (Development Safety Update Report, DSUR)
- kliinisten tutkimusten seurantatoimikunta (DSMB)
- lääketieteellinen koodaus
- validoitu turvallisuustietokanta
- tutkimus- ja turvallisuustietokantojen täsmäyttäminen
Lue lisää
Tiedonhallinta ja -käsittely
- tiedonkäsittely (sähköiset tietojenkeruulomakkeet, eCRF)
- tallennetun tiedon tarkennuspyyntöihin vastaaminen

Kliinisten tutkimusten lopetus
Tutkimus etenee jännittävimpään vaiheeseensa, kun tietokanta suljetaan ja projekti lähestyy raportointivaihetta. Tutkimuksen toteutus ja saadut tulokset on tärkeää dokumentoida tieteellisten ja viranomaisten vaatimusten mukaisesti.
Tutkimuksen lopetusvaihe sisältää:
- Tutkimuskeskusten lopetuskäynnit
- Ilmoitukset tutkimuksen päättymisestä riippumattomalle eettiselle toimikunnalle ja viranomaiselle, CTIS portaaliin
- Kliinisen lääketutkimuksen kantatiedoston (TMF) palautus
- Lääketurva- ja valvontatoimet
- Tietoaineiston tarkistus, tietokannan lukitseminen ja tilastolliset analyysit alihankkijan avulla
- Kliinisen tutkimuksen raportit
- väliraportit
- loppuraportit
- taulukot ja listaukset
- Tieteelliset julkaisut
- Arkistointi
Medfiles on tutkimuskumppani, joka panostaa tuloksiisi ja omistautuu tutkimuksesi onnistumiselle. Kun valitset meidät tutkimuskumppaniksesi, voit olla varma, että tutkimus toteutetaan lainsäädännön, hyvän tutkimustavan ja toiveidesi mukaisesti. Kysy apua projektin yksittäiseen vaiheeseen tai koko tutkimuksen kattavaa ratkaisua!

Maksuton opas: nopeat vinkit onnistuneisiin CTIS-hakemuksiin
CTIS-portaali tuo uusia vastuita ja vaatimuksia sekä herättää kysymyksiä. Medfiles on koonnut käytännönläheisen oppaan siitä, kuinka voit onnistuneesti toimittaa kliinisten tutkimusten hakemuksesi. Tieto on erityisesti suunnattu akateemisille tutkijoille, jotka suorittavat kliinisiä tutkimuksia Suomessa.
Maksuton opas: Miten MDR-asetuksen edellyttämä hyvä kliininen käytäntö toteutetaan?
Lääkinnällisiä laitteita koskevan asetuksen mukaan kliiniset tutkimukset on suoritettava hyvän kliinisen käytännön mukaisesti. Tutkimusten toimeksiantajien onkin noudatettava MDR-asetuksen vaatimuksia ja lisäksi tunnettava hyvin myös ISO-standardin vaatimukset. Medfiles on laatinut hyvän kliinisen käytännön oppaan asioista, joita toimeksiantajien olisi hyvä tietää tutkimuksen valmistelusta, monitoroinnista ja päättämisestä.
Kliinisten tutkimuspalvelujen tiiminvetäjät

Essi Sarkkinen
Director, Development & Operations
Essi Sarkkinen on työskennellyt Medfilesilla vuodesta 2014 lähtien, ensin Elintarvikkeet & Rehut ja Kosmetiikka yksikön vetäjänä ja sen jälkeen viimeisen viiden vuoden ajan Medfilesin Kliiniset tutkimuspalvelut yksikön johtajana, jossa hänen vastuullaan oli Suomessa ja Baltiassa työskentelevä 14 asiantuntijan tiimi. Vuoden 2024 alussa hänet nimitettiin Director of Development & Operations -rooliin.
Essillä on tohtorintutkinto kliinisestä ravitsemuksesta, ja hän toimii dosenttina Itä-Suomen yliopistossa. Essi on julkaissut kymmeniä tieteellisiä artikkeleita vertaisarvioiduissa tieteellisissä julkaisuissa ja ohjannut neljää akateemista väitöskirjaa. Akateemisen uransa jälkeen Essi on johtanut elintarvike- ja ravitsemusalan tutkimuspalvelutoimintaa jo yli 15 vuoden ajan. 2000-luvun alussa Essi alkoi työskennellä lääkkeiden kliinisten tutkimusten ja hyvän kliinisen tutkimustavan (GCP) sekä elintarvikkeita koskevien viranomaisvaatimusten ja niihin liittyvän lainsäädännön parissa, mukaan lukien terveysväitteet ja uuselintarvikkeet.
Essillä on yhteensä yli 30 vuoden kokemus kliinisistä tutkimuksista ja lääketieteellisestä kirjoittamisesta sekä runsaasti osaamista tutkimus- ja kehitystyöstä sekä elintarvikkeiden, lääkinnällisten laitteiden ja lääkkeiden viranomaisvaatimuksista ja niihin liittyvästä lainsäädännöstä. Kaiken kaikkiaan hän on työskennellyt erilaisissa tutkimuspalvelualan johtotehtävissä jo yli 25 vuoden ajan.

Satu Koskimies
Head of Clinical Operations
Satu Koskimies on työskennellyt Medfilesilla vuodesta 2022 lähtien, ensin kliinisenä projektipäällikkönä ja vuoden 2023 alusta kliinisten tutkimuspalvelujen vetäjänä. Taustaltaan Satu on kokenut kliinisen tutkimuksen ammattilainen ja koulutukseltaan filosofian maisteri, pääaineenaan biologia. Lisäksi hänellä on sairaanhoidollinen koulutus.
Vuodesta 2001 alkaen Satulle on kertynyt yli kahden vuosikymmenen kokemus kliinisten tutkimusten projektinhallinnasta ja koordinoinnista, lääketieteellisestä kirjoittamisesta ja lääkealan viranomaisvaatimuksista ja lainsäädännöstä. Satu toimii lääkkeiden ja lääkinnällisten laitteiden parissa, ja aiemmin hän onkin työskennellyt tutkimuspalveluyrityksissä sekä lääkkeitä ja laitteita kehittävissä yrityksissä. Laadunhallintajärjestelmien ja uusien toimintatapojen luominen sekä tutkimustoiminnan laadun kehittäminen monin eri tavoin ovat aina olleet Satun suosikkitehtäviä koko hänen uransa ajan.
Kliinisten tutkimuspalvelujen vetäjänä Satu tukee ja johtaa Medfilesin kliinisten tutkimuspalveluiden tiimiä, joka koostuu ammattitaitoisista, asiantuntevista ja tärkeälle työlleen omistautuneista projektipäälliköistä ja tutkimuskoordinaattoreista.
Ota yhteyttä
Sinua voisi kiinnostaa:
- Kliiniset tutkimuspalvelut lääkinnällisille laitteille
- Kliiniset tutkimuspalvelut elintarvikkeille
- Kliiniset tutkimuspalvelut lääkkeille
- Lääketieteellinen kirjoittaminen
- Opas: Miten MDR-asetuksen edellyttämä hyvä kliininen käytäntö toteutetaan?
- Tutustu asiantuntijaamme: CRA varmistaa kliinisen tutkimuksen onnistumisen
- Maksuton opas: Vinkit onnistuneisiin CTIS-hakemuksiin
